¿Qué es un átomo?
El átomo es la partícula más simple y fundamental que compone la materia. Es decir, todo lo que conocemos y vemos, está formado por átomos, en distintas materias y composiciones, pero todo se forma en su estructura más sencilla, por átomos. A lo largo de la historia, nuestra comprensión del átomo ha evolucionado desde su concepción como una entidad indivisible hasta el descubrimiento de sus componentes subatómicos y su estructura interna. A través de los avances científicos y tecnológicos, hemos logrado desentrañar los misterios de esta diminuta entidad y comprender su papel fundamental en la formación de elementos, moléculas y la creación del universo tal como lo conocemos.
Estructura del átomo.
El átomo se compone de tres partículas fundamentales: protones, neutrones y electrones. El núcleo, ubicado en el centro del átomo, contiene protones y neutrones. Los protones son partículas cargadas positivamente, mientras que los neutrones son partículas sin carga eléctrica. Estas dos partículas se unen para formar el núcleo del átomo, que representa aproximadamente el 99,9% de la masa total del átomo, a pesar de ocupar solo una fracción minúscula del volumen del átomo.
Alrededor del núcleo, los electrones se encuentran en una región conocida como nube electrónica. Los electrones son partículas cargadas negativamente y orbitan alrededor del núcleo en diferentes niveles de energía, también llamados capas electrónicas. La cantidad de electrones en un átomo determina sus propiedades químicas y reactividad.
Partículas subatómicas.
Dentro del núcleo, encontramos los protones y los neutrones. Los protones son partículas con carga eléctrica positiva, cada uno de ellos con una carga elemental de +1. El número de protones en un átomo determina su número atómico, que es utilizado para clasificar los elementos en la tabla periódica. Por ejemplo, el hidrógeno tiene un protón y su número atómico es 1, mientras que el oxígeno tiene 8 protones y su número atómico es 8.
Los neutrones, por otro lado, son partículas sin carga eléctrica. A diferencia de los protones, el número de neutrones en un átomo puede variar, dando lugar a diferentes isótopos de un elemento. Los isótopos son átomos que tienen el mismo número de protones pero diferente número de neutrones. Por ejemplo, el nitrógeno puede tener un isótopo con 7 neutrones y otro con 8 neutrones.
El descubrimiento de los electrones en 1897 por J.J. Thomson reveló la existencia de partículas con carga negativa. Estas partículas se encuentran en la nube electrónica alrededor del núcleo y están involucradas en las interacciones químicas y las propiedades electromagnéticas de los átomos.
Historia del átomo.
La noción del átomo como una entidad indivisible fue planteada por primera vez por los filósofos griegos Leucipo y Demócrito en el siglo V a.C. El término "átomo" se originó en esa época y se utilizó para describir una partícula que no podía dividirse más.
Sin embargo, la idea del átomo fue revivida en el siglo XIX por John Dalton. Dalton propuso una teoría atómica en 1805, en la que los átomos se consideraban como partículas indivisibles que se combinaban para formar compuestos químicos.
A medida que avanzaba el siglo XIX, se realizaron descubrimientos fundamentales que ampliaron nuestra comprensión del átomo. En 1897, J.J. Thomson descubrió el electrón y propuso un modelo en el que los electrones estaban incrustados en una masa positiva, conocido como el modelo de "pudín con pasas".
En 1911, Ernest Rutherford llevó a cabo el famoso experimento de la lámina de oro, que reveló la existencia de un núcleo central cargado positivamente en el átomo. Este descubrimiento condujo a un nuevo modelo atómico en el que los electrones orbitaban alrededor del núcleo, similar al sistema solar.
Niels Bohr, en 1913, propuso el modelo atómico planetario, en el que los electrones se movían en órbitas predeterminadas alrededor del núcleo. Este modelo explicaba de manera más precisa las propiedades espectrales del átomo y sentó las bases para la comprensión de la estructura electrónica.
Con el tiempo, se descubrieron nuevas partículas subatómicas, como el protón en 1919 y el neutrón en la década de 1930. La construcción de aceleradores de partículas permitió el descubrimiento de partículas aún más pequeñas, como los quarks, que componen los protones y neutrones.
El modelo atómico cuántico, desarrollado a principios del siglo XX, es el más reciente en nuestra comprensión del átomo. Según este modelo, los electrones se describen mediante funciones de onda y se encuentran en una nube de probabilidades alrededor del núcleo. Este enfoque cuántico ha permitido explicar con mayor precisión las propiedades y comportamientos de los átomos.
Aplicaciones del átomo.
Aplicaciones civiles:
Energía nuclear: La fisión nuclear, que consiste en la división del núcleo atómico, se utiliza en las centrales nucleares para generar electricidad de manera masiva. El principio consiste en que las barras de plutonio calienten el agua tanto que se genera el vapor necesario para mover las turbinas, generando entonces la electricidad. Esta forma de energía es una fuente potente y eficiente y relativamente barata, aunque también plantea desafíos en cuanto a la seguridad y sobre todo, la gestión de residuos radiactivos.
Medicina nuclear: La radiactividad controlada de ciertos isótopos radiactivos se utiliza en la medicina para el diagnóstico y tratamiento de enfermedades. Por ejemplo, el uso de isótopos radiactivos en la tomografía por emisión de positrones (PET) permite obtener imágenes detalladas del funcionamiento del cuerpo humano y detectar enfermedades como el cáncer, permitiendo lograr mejoras en salud de los enfermos y heridos.
Datación radiométrica: La descomposición radiactiva de ciertos isótopos se utiliza para determinar la edad de materiales y fósiles. Esto es especialmente útil en la arqueología, paleontología y geología para establecer cronologías y comprender la historia de la Tierra y sus procesos, por medio de conocer la edad precisa de los elementos que se hayan estudiado.
Industria: Los isótopos radiactivos se emplean en diversas aplicaciones industriales, como la inspección de soldaduras, la medición de espesores y la detección de fugas en tuberías. Además, se utilizan en la esterilización de productos médicos y alimentos, ya que la radiación puede eliminar microorganismos y prolongar la vida útil.
Aplicaciones militares:
Energía nuclear para propulsión: Los submarinos nucleares utilizan reactores nucleares para generar energía y propulsar los barcos. Esto les otorga una autonomía prácticamente ilimitada, ya que no dependen de la carga de combustible convencional, donde por ejemplo, un submarino tradicional a diésel, necesita 'repostar' cada tres meses, en cambio el submarino nuclear puede estar navegando sin mayor límite que la alimentación y salud de la tripulación humana presente en su interior.
Armas nucleares: La fisión nuclear también se ha utilizado para desarrollar armas nucleares, que aprovechan la energía liberada en una reacción nuclear para causar destrucción masiva. Esto tristemente ha mostrado ya su eficacia destructora en las ciudades de Hiroshima y Nagasaki, donde en unos cuantos segundos, cientos de miles de personas murieron a la vez que toda la infraestructura física de esas ciudades quedó devastada. Aunque su uso está altamente regulado y se busca su no proliferación, su existencia ha influido en el equilibrio de poder en las relaciones internacionales.
Entonces podemos resumir que, el átomo, como la unidad básica de la materia, ha sido objeto de estudio y descubrimiento a lo largo de los siglos. Desde su concepción como una partícula indivisible hasta la comprensión actual de su estructura subatómica, los avances científicos y tecnológicos han permitido revelar los componentes y la naturaleza fundamental del átomo.
La estructura del átomo, con su núcleo que contiene protones y neutrones, rodeado por una nube electrónica de electrones, es la base para la formación de elementos, la creación de moléculas y las propiedades químicas y físicas de la materia.
El estudio del átomo ha impulsado no solo el desarrollo de la química y la física, sino también de disciplinas como la astrofísica y la cosmología, que buscan comprender la formación y evolución del universo. Además se han logrado importantes aplicaciones tanto civiles como militares, con base en el profundo conocimiento de este elemento.
A medida que continuamos explorando los límites de la física y la comprensión del átomo, es emocionante pensar en las posibilidades futuras que pueden surgir de nuestro conocimiento de esta entidad fundamental de la materia.
Características de un átomo.
Estructura subatómica: El átomo está compuesto por tres partículas fundamentales: protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo, que es el centro del átomo, mientras que los electrones orbitan alrededor del núcleo en regiones llamadas niveles de energía.
Tamaño relativo: Los átomos son extremadamente pequeños y su tamaño se mide en unidades de longitud llamadas picómetros (pm). Por ejemplo, un átomo de hidrógeno tiene un diámetro de aproximadamente 0,1 nm (nanómetros), lo que equivale a 1 angstrom (Å) o 100 pm.
Carga eléctrica: Los protones tienen carga eléctrica positiva, los electrones tienen carga eléctrica negativa y los neutrones no tienen carga eléctrica (son eléctricamente neutros). La carga positiva de los protones equilibra la carga negativa de los electrones, lo que hace que el átomo en su conjunto sea eléctricamente neutro.
Número atómico: Cada átomo se caracteriza por su número atómico (Z), que corresponde al número de protones en su núcleo. Es el número que determina la posición del elemento en la tabla periódica y establece sus propiedades químicas distintivas.
Isótopos: Los átomos de un mismo elemento pueden variar en el número de neutrones en su núcleo, lo que da lugar a diferentes isótopos. Los isótopos tienen el mismo número de protones y, por lo tanto, pertenecen al mismo elemento, pero difieren en su masa atómica debido al número de neutrones. Por ejemplo, el hidrógeno tiene tres isótopos principales: protio (sin neutrones), deuterio (1 neutrón) y tritio (2 neutrones).
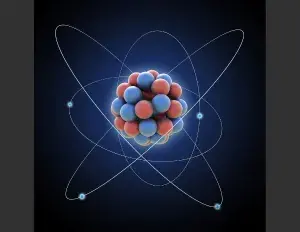
Un átomo es la partícula más simple y elemental que compone la materia.
5 ejemplos de átomo.
Átomo de Hidrógeno (H): El átomo de hidrógeno es el átomo más simple y ligero. Consiste en un protón en su núcleo y un electrón orbitando alrededor. Es el elemento más abundante en el universo.
Átomo de Oxígeno (O): El átomo de oxígeno, el cual es esencial para el sustento de la vida. Posee 8 protones y 8 neutrones en su núcleo, con 8 electrones en su nube electrónica. Es un componente fundamental del agua y de muchas moléculas orgánicas e inorgánicas.
Átomo de Carbono (C): El átomo de carbono es el elemento central de la química orgánica. Tiene 6 protones y 6 neutrones en su núcleo, y 6 electrones en su nube electrónica. Es capaz de formar enlaces covalentes con otros átomos de carbono y una amplia variedad de elementos, dando lugar a una enorme diversidad de compuestos.
Átomo de Hierro (Fe): El átomo de hierro es un metal de transición y uno de los elementos más abundantes en la corteza terrestre. Posee 26 protones, 30 neutrones y 26 electrones. Es utilizado en la fabricación de acero y en diversas aplicaciones industriales.
Átomo de Oro (Au): El átomo de oro es un metal precioso y muy valorado por su belleza y rareza. Tiene 79 protones, 118 neutrones y 79 electrones. El oro ha sido utilizado a lo largo de la historia para fines ornamentales, en joyería, y también en aplicaciones tecnológicas y médicas.
Para finalizar, basta recapitular que, el átomo es la partícula más simple y fundamental que compone la materia. Es decir, todo lo que conocemos y vemos, está formado por átomos, en distintas materias y composiciones, pero todo se forma en su estructura más sencilla, por átomos. A lo largo de la historia, nuestra comprensión del átomo ha evolucionado desde su concepción como una entidad indivisible hasta el descubrimiento de sus componentes subatómicos y su estructura interna. A través de los avances científicos y tecnológicos, hemos logrado desentrañar los misterios de esta diminuta entidad y comprender su papel fundamental en la formación de elementos, moléculas y la creación del universo tal como lo conocemos.

Un ejemplo de átomo, es el del oro.
En LEGSA, encontrarás respuestas a varias de las preguntas cotidianas y universales, que nos hacemos todos los días.